器官纤维化是多种疾病的主要病理学特征,而全球疾病死因约有三分之一归于纤维化。肺纤维化导致患者呼吸衰竭和死亡,平均生存周期低于肺癌。现有药物无法有效逆转纤维化进程。促进纤维化肺组织再生可望恢复受损的肺泡和血管结构,为包括肺纤维化在内的多种疾病治疗提供策略。因此发掘肺修复中促再生并抑制纤维化治疗靶点具有临床价值。
丁楅森团队以往工作发现血管内皮细胞通过旁分泌Angiocrine因子与邻近的上皮、间质及血液细胞互作从而调控肺的再生和纤维化(文献1-6)。近日,9999js金沙老品牌丁楅森团队在Cell Metabolism发表题为“Dopaminylation of endothelial TPI1 suppresses ferroptotic angiocrine signals to promote lung regeneration over fibrosis”的研究论文。该研究通过整合点击化学、蛋白组学、结构生物学、基因敲除/敲入鼠、临床分析等多学科手段,发现多巴胺通过修饰肺血管TPI1调控Angiocrine因子,抑制铁死亡从而促进肺再生并抑制纤维化。

蛋白修饰作为分子开关,可迅速调节细胞状态,包括调控内皮细胞增殖等。单胺类神经递质,如多巴胺、五羟色胺、去甲肾上腺素和组胺,可以通过TGM2酶活性共价修饰蛋白质。该研究首先利用小鼠肺再生模型、单细胞测序(scRNA-seq)、血管内皮特异性敲除TGM2(Tgm2i∆EC/i∆EC)以及特异性敲入铁死亡抑制因子GPX4(Gpx4EC KI)和FSP1(Fsp1EC GOF)小鼠,发现TGM2依赖的多巴胺化修饰通过抑制血管内皮铁死亡促进肺的再生。为了在血管内皮细胞中鉴定多巴胺化修饰的靶蛋白,整合了化学蛋白质组学和点击化学技术发现内皮细胞TPI1是主要的多巴胺化修饰蛋白。然后利用体外筛选、体内模型以及内皮特异性基因敲除/敲入鼠,证明了TPI1作为TGM2介导的多巴胺化修饰靶点,在肺再生过程中抑制内皮细胞铁死亡。
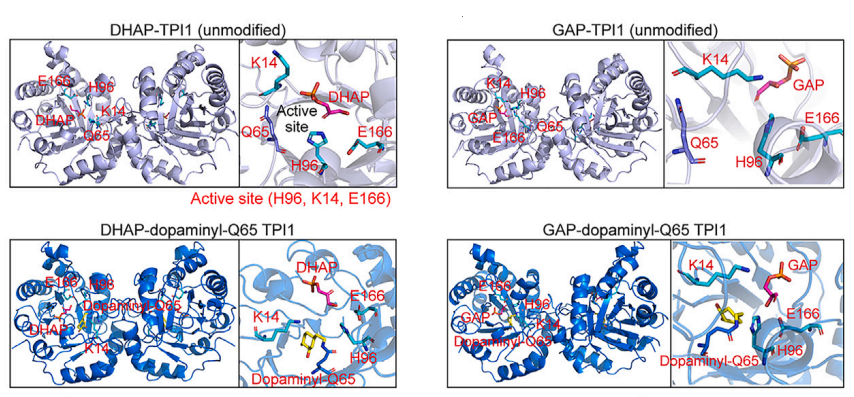
TPI1是一种代谢酶,可以催化醚磷脂合成前体DHAP与葡萄糖关键代谢物GAP之间的相互转化。作者们进一步通过质谱分析,发现TPI1多巴胺化修饰发生在其Q65氨基酸位点。通过蛋白结构分析,TPI1 Q65位点的多巴胺化修饰增强了其催化残基与DHAP之间的接触,引导酶促反应朝着将DHAP转化为GAP的方向进行。
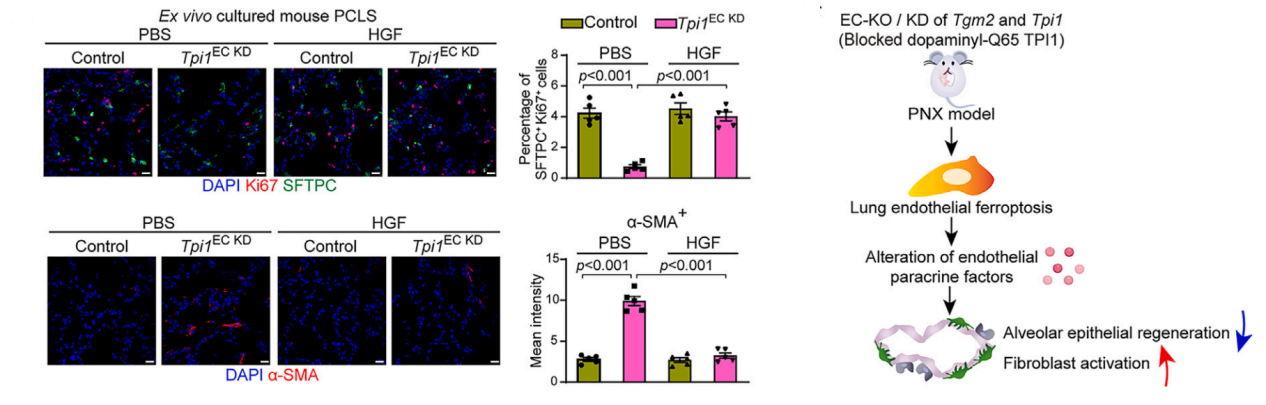
血管内皮细胞通过旁分泌Angiocrine因子形成“引导性血管微环境”,调控肺再生和纤维化。利用肺再生模型和肺组织精细切片(PCLS),发现在再生肺内皮细胞中阻断TPI1多巴胺化会诱发铁死亡,重编程血管微环境旁分泌因子信号。这种受损的血管内皮旁分泌功能促进了成纤维细胞的活化,并减少了肺泡上皮细胞的再生。
因为在肺再生过程中阻断内皮TPI1多巴胺化修饰会促进成纤维细胞活化,进而直接探究TPI1多巴胺化修饰在肺纤维化患者和肺纤维化小鼠模型中的作用。研究发现在人和小鼠纤维化肺内皮细胞中,TPI1多巴胺化修饰的水平显著降低。进一步利用血管内皮特异性FSP1表达小鼠,发现TPI1多巴胺化修饰可以抑制肺内皮细胞铁死亡,从而缓解肺纤维化。最后,通过小分子药物恢复内皮TPI1多巴胺化修饰水平,能够抑制内皮细胞铁死亡并下调促纤维化旁分泌因子,减轻肺纤维化。
综上,该研究发现了肺血管微环境靶点TPI1的多巴胺化修饰在肺再生中平衡了内皮脂质/葡萄糖代谢,并抑制了促纤维化的铁死亡,从而维持促再生的Angiocrine功能,并抑制肺纤维化。所揭示的Angiocrine调控机制可为器官纤维化的再生疗法提供靶点,开发靶向血管微环境药物。

9999js金沙老品牌莫春横博士及研究生黎慧、闫孟利、许诗雨、吴锦焰、李家晨和杨昕淳为论文的共同第一作者。9999js金沙老品牌丁楅森为最后通讯作者,9999js金沙老品牌为第一单位。
论文链接:https://doi.org/10.1016/j.cmet.2024.07.008
参考文献
1. Rafii, S., Butler, J. M., and Ding, B. S. (2016) Angiocrine functions of organ-specific endothelial cells. Nature 529, 316-3252.
2. Cao, Z., Lis, R., Ginsberg, M., Chavez, D., Shido, K., Rabbany, S. Y., Fong, G. H., Sakmar, T. P., Rafii, S., and Ding, B. S. (2016) Targeting of the pulmonary capillary vascular niche promotes lung alveolar repair and ameliorates fibrosis. Nature medicine 22, 154-1623.
3. Rafii, S., Cao, Z., Lis, R., Siempos, II, Chavez, D., Shido, K., Rabbany, S. Y., and Ding, B. S. (2015) Platelet-derived SDF-1 primes the pulmonary capillary vascular niche to drive lung alveolar regeneration. Nature Cell Biology 17, 123-1364.
4. Ding, B. S., Cao, Z., Lis, R., Nolan, D. J., Guo, P., Simons, M., Penfold, M. E., Shido, K., Rabbany, S. Y., and Rafii, S. (2014) Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis. Nature 505, 97-1025.
5. Ding, B. S., Yang, D., Swendeman, S. L., Christoffersen, C., Nielsen, L. B., Friedman, S. L., Powell, C. A., Hla, T., and Cao, Z. (2020) Aging Suppresses Sphingosine-1-Phosphate Chaperone ApoM in Circulation Resulting in Maladaptive Organ Repair. Developmental cell 53, 677-690 e6746.
6. Chen, Y., Pu, Q., Ma, Y., Zhang, H., Ye, T., Zhao, C., Huang, X., Ren, Y., Qiao, L., Liu, H. M., Esmon, C. T., Ding, B. S., and Cao, Z. (2021) Aging Reprograms the Hematopoietic-Vascular Niche to Impede Regeneration and Promote Fibrosis. Cell Metabolism 33, 395-410 e394
